Curso de Aquarismo - Aula 2 - Ciclo do Nitrogênio
Enviado: 04 Set 2009, 23:36
Nessa aula falaremos sobre os processos de decomposição de matéria orgânica.
Decomposição da matéria orgânica – Ciclo do Nitrogênio:
O equilíbrio de um sistema biológico depende, em grande parte, da decomposição da matéria orgânica, provendo uma reciclagem dos elementos. No aquário - seja ele marinho ou de água doce - geralmente não se consegue atingir esse equilíbrio. Esse é o motivo pelo qual as técnicas de filtragem são empregadas.
Os seres responsáveis pela decomposição da matéria orgânica são os vários tipos de bactérias que vivem no aquário. Bactérias que vivem na presença de oxigênio (O2) são chamadas de aeróbicas e as que não necessitam do oxigênio são as anaeróbicas. Vários tipos de bactérias aeróbicas e anaeróbicas vivem no aquário, em qualquer material poroso que nele se encontre.
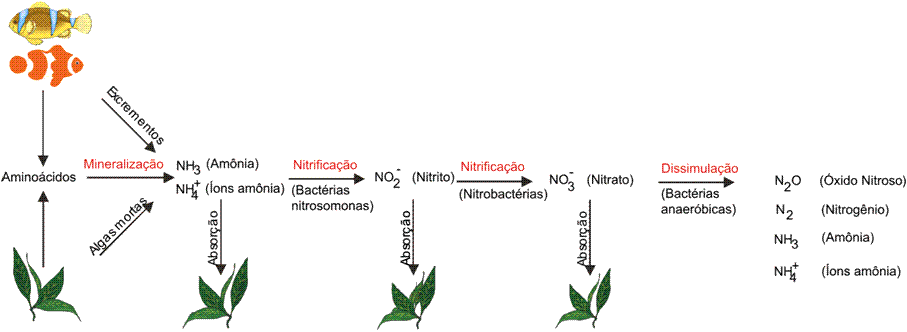
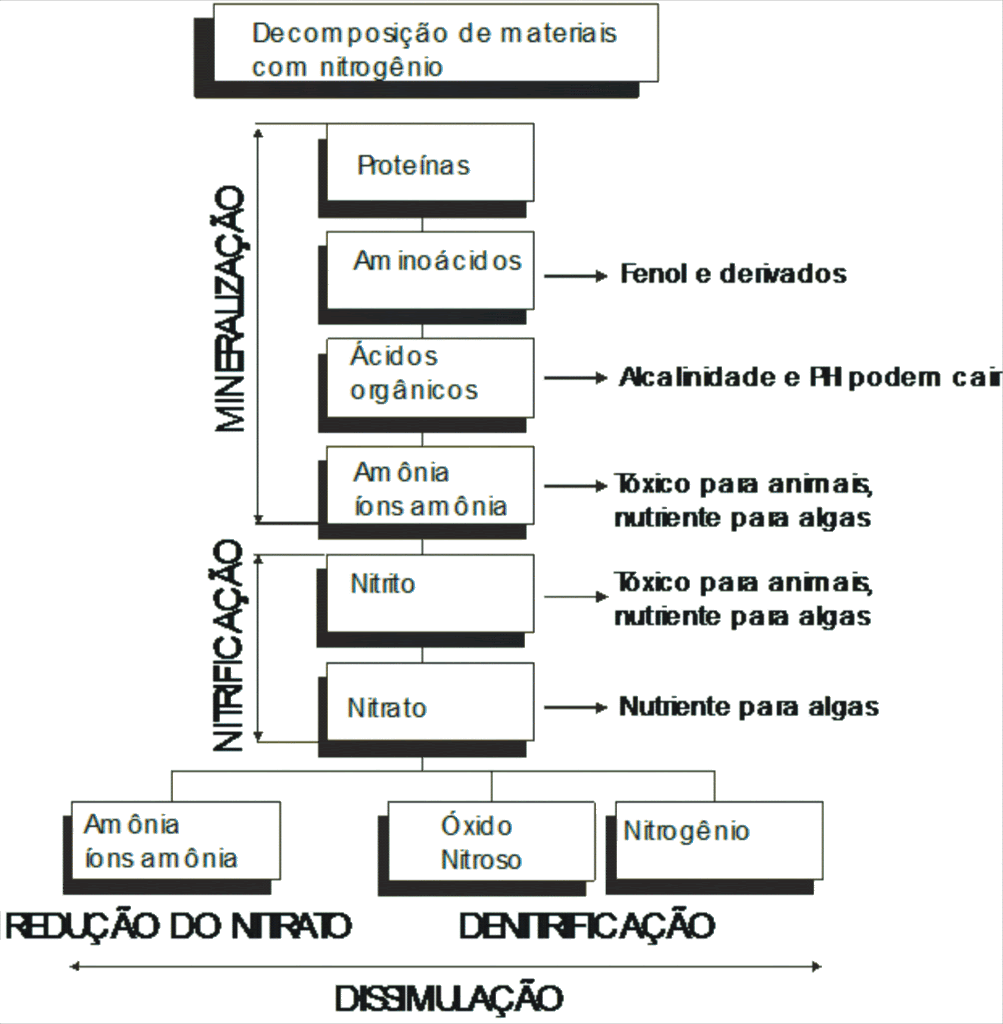
A decomposição de componentes que contém nitrogênio pode ser simplificada em três etapas :
- Mineralização;
- Nitrificação;
- Dissimulação.
a) Mineralização :
Nessa etapa do processo de decomposição, os aminoácidos (elementos que compõem proteínas) são “quebrados”.
Bactérias heterotróficas retiram o CO2 dos aminoácidos e os decompõem. Como produto da mineralização , temos amônia e ácidos orgânicos. Os ácidos orgânicos vão reagindo com carbonatos do aquário e a reserva alcalina vai diminuindo.
A amônia (NH3) também surge dos excrementos dos animais, de algas mortas e de restos de alimentos.
Amônia tem relação direta com os íons amônia (NH4+). Em um PH de 8,3 a relação amônia - íons amônia é de 1 para 9. Os íons amônia são menos tóxicos aos animais que a amônia. A relação pode ser representada da seguinte forma :
NH4+ + H2O <---> NH3 + H3O+
b) Nitrificação :
Na próxima etapa da decomposição da matéria orgânica ocorre a oxidação dos íons amônia e da amônia, formando o Nitrito (NO2-) e o Nitrato (NO3-). Essas reações são realizadas por dois grupos de bactérias, as nitrosomonas, que oxidam os íons amônia e a amônia em nitrito, e as nitrobactérias, que oxidam o nitrito em nitrato.
Abaixo temos as reações :
reação realizada pelas bactérias nitrosomonas:
2NH4+ + 2OH- + 3O2 ---> 2H+ + 2NO2- + 4H2O
reações que são realizadas pelas nitrobactérias:
2NO2- + O2 ---> 2NO3-
c) Dissimulação :
Na última fase do processo de decomposição, o nitrato continua sendo “transformado”. Vários tipos de bactérias podem estar presentes no processo de dissimulação. Os produtos que podem surgir da dissimulação são :
- Óxido Nitroso (N2O);
- Nitrogênio (N2);
- Amônia / íons Amônia (NH3 / NH4+).
Óxido Nitroso e Nitrogênio são gases que não reagem com água. Quando eles são o produto final da decomposição, falamos no processo de denitrificação. Esse processo é realizado por bactérias anaeróbicas, que retiram o O2 do nitrato (NO3-), resultando nos dois gases que deixam o aquário. Essa é a forma ideal de ocorrer o processo de decomposição.
Quando o produto final da decomposição for amônia e íons amônia, falamos no processo de redução do nitrato. Nesse caso, concentrações altas de amônia/íons amônia no aquário podem ser a conseqüência. Felizmente, dificilmente o processo de redução do nitrato é predominante no aquário.
No esquema abaixo, temos representado o processo de decomposição :
Embora não seja necessário para o aquarista saber química, é necessário ter em mente o que ocorre no aquário e onde devemos interferir. O excesso de matéria orgânica em decomposição deve ser evitado.
No aquarismo sempre se fala sobre a decomposição de elementos com nitrogênio em sua composição. Existem, entretanto, outros componentes da decomposição que devemos nos atentar. Fosfato é um desses componentes. Está presente na água como PO43-, H2PO4- e HPO42-. O fosfato é gerado pela decomposição de plantas, organismos planctônicos e microorganismos.
Os sistemas de filtragem, assunto da nossa próxima aula, tratam de como retirar matéria orgânica antes do processo de decomposição ou de como acelerar esses processos.
Até lá.
abraço
Decomposição da matéria orgânica – Ciclo do Nitrogênio:
O equilíbrio de um sistema biológico depende, em grande parte, da decomposição da matéria orgânica, provendo uma reciclagem dos elementos. No aquário - seja ele marinho ou de água doce - geralmente não se consegue atingir esse equilíbrio. Esse é o motivo pelo qual as técnicas de filtragem são empregadas.
Os seres responsáveis pela decomposição da matéria orgânica são os vários tipos de bactérias que vivem no aquário. Bactérias que vivem na presença de oxigênio (O2) são chamadas de aeróbicas e as que não necessitam do oxigênio são as anaeróbicas. Vários tipos de bactérias aeróbicas e anaeróbicas vivem no aquário, em qualquer material poroso que nele se encontre.
A decomposição de componentes que contém nitrogênio pode ser simplificada em três etapas :
- Mineralização;
- Nitrificação;
- Dissimulação.
a) Mineralização :
Nessa etapa do processo de decomposição, os aminoácidos (elementos que compõem proteínas) são “quebrados”.
Bactérias heterotróficas retiram o CO2 dos aminoácidos e os decompõem. Como produto da mineralização , temos amônia e ácidos orgânicos. Os ácidos orgânicos vão reagindo com carbonatos do aquário e a reserva alcalina vai diminuindo.
A amônia (NH3) também surge dos excrementos dos animais, de algas mortas e de restos de alimentos.
Amônia tem relação direta com os íons amônia (NH4+). Em um PH de 8,3 a relação amônia - íons amônia é de 1 para 9. Os íons amônia são menos tóxicos aos animais que a amônia. A relação pode ser representada da seguinte forma :
NH4+ + H2O <---> NH3 + H3O+
b) Nitrificação :
Na próxima etapa da decomposição da matéria orgânica ocorre a oxidação dos íons amônia e da amônia, formando o Nitrito (NO2-) e o Nitrato (NO3-). Essas reações são realizadas por dois grupos de bactérias, as nitrosomonas, que oxidam os íons amônia e a amônia em nitrito, e as nitrobactérias, que oxidam o nitrito em nitrato.
Abaixo temos as reações :
reação realizada pelas bactérias nitrosomonas:
2NH4+ + 2OH- + 3O2 ---> 2H+ + 2NO2- + 4H2O
reações que são realizadas pelas nitrobactérias:
2NO2- + O2 ---> 2NO3-
c) Dissimulação :
Na última fase do processo de decomposição, o nitrato continua sendo “transformado”. Vários tipos de bactérias podem estar presentes no processo de dissimulação. Os produtos que podem surgir da dissimulação são :
- Óxido Nitroso (N2O);
- Nitrogênio (N2);
- Amônia / íons Amônia (NH3 / NH4+).
Óxido Nitroso e Nitrogênio são gases que não reagem com água. Quando eles são o produto final da decomposição, falamos no processo de denitrificação. Esse processo é realizado por bactérias anaeróbicas, que retiram o O2 do nitrato (NO3-), resultando nos dois gases que deixam o aquário. Essa é a forma ideal de ocorrer o processo de decomposição.
Quando o produto final da decomposição for amônia e íons amônia, falamos no processo de redução do nitrato. Nesse caso, concentrações altas de amônia/íons amônia no aquário podem ser a conseqüência. Felizmente, dificilmente o processo de redução do nitrato é predominante no aquário.
No esquema abaixo, temos representado o processo de decomposição :

Embora não seja necessário para o aquarista saber química, é necessário ter em mente o que ocorre no aquário e onde devemos interferir. O excesso de matéria orgânica em decomposição deve ser evitado.

No aquarismo sempre se fala sobre a decomposição de elementos com nitrogênio em sua composição. Existem, entretanto, outros componentes da decomposição que devemos nos atentar. Fosfato é um desses componentes. Está presente na água como PO43-, H2PO4- e HPO42-. O fosfato é gerado pela decomposição de plantas, organismos planctônicos e microorganismos.
Os sistemas de filtragem, assunto da nossa próxima aula, tratam de como retirar matéria orgânica antes do processo de decomposição ou de como acelerar esses processos.
Até lá.
abraço